化学反应HC2O4–(ag)+C6H5O–(ag) === C2O42–(ag)+C6H5OH(ag) (1)计算反应在298.15 K时的ΔrGmΘ(298.15); (2)当反应物的浓度皆为0.01mol·L–1,生成物的浓度皆为0.1mol·L–1时,反应向哪个方向进行? (已知H2C2O4 Ka2Θ=6.4×10–5,C6H5OH的KaΘ=1.0×10–10)
正确答案:

(2)反应商: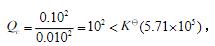 所以反应正向进行。
所以反应正向进行。
(或根据rGm的正、负判断:rGm==ΔrGmΘ+RTLnQ= –32.84+RTln100 = –32.84+11.41= –21.43(kJ·mol–1
)<0。

(2)反应商:
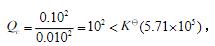 所以反应正向进行。
所以反应正向进行。(或根据rGm的正、负判断:rGm==ΔrGmΘ+RTLnQ= –32.84+RTln100 = –32.84+11.41= –21.43(kJ·mol–1
)<0。
答案解析:有

微信扫一扫手机做题
